Dernière mise à jour à 15h33 le 24/08
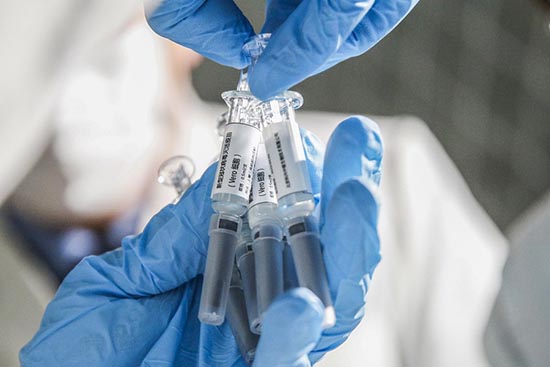 |
| (Xinhua/Zhang Yuwei) |
La Chine a déjà autorisé l'utilisation d'urgence des vaccins COVID-19 développés par des entreprises nationales, a annoncé le 22 août un haut responsable de la santé.
Selon Zheng Zhongwei, directeur du groupe de travail chinois sur le développement du vaccin COVID-19 et responsable de la Commission nationale de la santé, l'utilisation d'urgence, qui est conforme à la loi chinoise sur la gestion des vaccins, permet aux candidats vaccins d'être utilisés pendant une période limitée chez certaines personnes présentant un fort risque de contracter la maladie, comme les travailleurs médicaux, les agents de lutte contre la pandémie de première ligne et les douaniers.
Les demandes d'utilisation d'urgence des vaccins COVID-19 ont commencé le 4 avril, et après diverses discussions et évaluations, le gouvernement central a approuvé le plan permettant leur utilisation le 24 juin et autorisé l'utilisation d'urgence des vaccins le 22 juillet, a-t-il déclaré lors d'un entretien avec la télévision centrale de Chine, ajoutant que cette décision fait suite à une série de mesures visant à garantir que l'utilisation d'urgence des vaccins est bien réglementée et surveillée.
Pour éviter une éventuelle résurgence de la pandémie du nouveau coronavirus à l'automne et en hiver, a-t-il ajouté, le nombre de personnes autorisées à être vaccinées sera encore élargi pour garantir que les villes puissent maintenir des fonctions normales en cas de crise sanitaire.
Par ailleurs, le prix des vaccins sera basé sur leurs coûts, plutôt que sur la demande du marché, a déclaré M. Zheng. « Cela ne veut pas dire que les entreprises ne pourront pas faire de profit avec les vaccins, mais la règle fondamentale est que le profit doit être modéré et raisonnable et basé sur les coûts de fabrication des vaccins ».
Enfin, a-t-il indiqué, la capacité de production des vaccins par les entreprises nationales peut répondre à la demande d'utilisation d'urgence et d'essais cliniques en cours.
Yang Xiaoming, PDG de China National Biotec Group (CNBG), une filiale du China National Pharmaceutical Group (Sinopharm), a de son côté déclaré que sa société avait signé des accords avec plusieurs pays sur les essais cliniques de phase trois du vaccin inactivé développé par la société au cours des derniers mois. « Plus de 20 000 personnes ont été vaccinées », a précisé M. Yang. « La sécurité des vaccins est bien garantie et son efficacité est étroitement surveillée ».
La cérémonie de lancement des essais cliniques de phase trois en Argentine du vaccin anti-COVID-19 inactivé développé par la société a eu lieu le 21 août à Beijing après que CNBG a obtenu l'approbation du processus. Le vaccin inactivé a également reçu l'approbation pour des essais cliniques de phase trois aux Émirats arabes unis le 23 juin, et au Pérou et au Maroc le 20 août.
Le 16 juin, CNBG a annoncé que les essais cliniques de phase un et de phase deux de son vaccin inactivé avaient démontré de bonnes performances en termes de sécurité et d'efficacité sur des volontaires vaccinés. Aucun sujet n'a présenté de réactions indésirables graves, a affirmé la société.
Selon l'Organisation mondiale de la santé, au 6 août, six candidats vaccins ont commencé des essais cliniques de phase trois, dont trois développés par la Chine.
 Hunan : des slacklineurs offrent un spectacle à haute altitude
Hunan : des slacklineurs offrent un spectacle à haute altitude Un hôpital transplante avec succès des reins de bébé à une femme
Un hôpital transplante avec succès des reins de bébé à une femme Deux bronzes de retour en Chine
Deux bronzes de retour en Chine La Chine compte 55 sites au Patrimoine mondial
La Chine compte 55 sites au Patrimoine mondial
 Le grand bazar d'Urumqi entre dans la haute saison touristique
Le grand bazar d'Urumqi entre dans la haute saison touristique Les « animateurs dégustateurs » offrent un festin visuel aux internautes
Les « animateurs dégustateurs » offrent un festin visuel aux internautes Les valeurs culturelles de la Journée internationale des musées dans une perspective mondiale
Les valeurs culturelles de la Journée internationale des musées dans une perspective mondiale Mort à 102 ans de I.M. Pei, l'architecte de la pyramide du Louvre
Mort à 102 ans de I.M. Pei, l'architecte de la pyramide du Louvre Ceux qui veulent nous rejoindre sur la messagerie WeChat, scannez le code QR ci-contre.
Ceux qui veulent nous rejoindre sur la messagerie WeChat, scannez le code QR ci-contre. Lhassa accueille une compétition d'escalade sur le thème « Une Ceinture, une Route »
Lhassa accueille une compétition d'escalade sur le thème « Une Ceinture, une Route » Ouverture à Beijing d'une exposition sur un site chinois du patrimoine mondial
Ouverture à Beijing d'une exposition sur un site chinois du patrimoine mondial Ouverture d'une exposition sur Balzac dans l'est de la Chine
Ouverture d'une exposition sur Balzac dans l'est de la Chine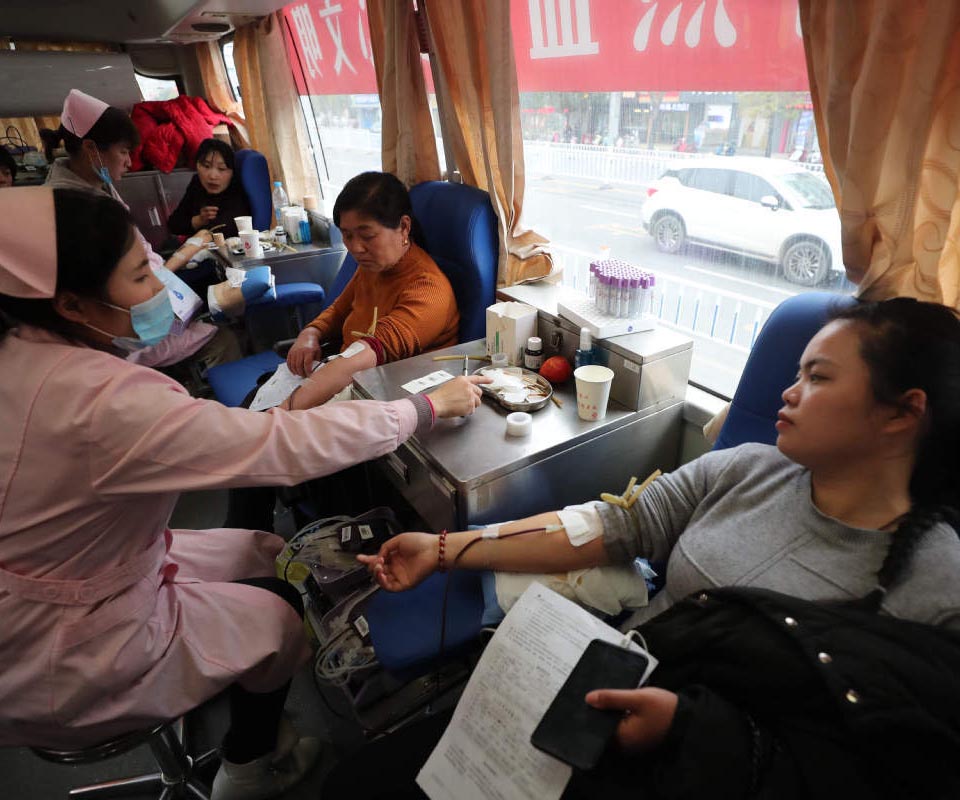 La Chine a enregistré 15 millions de dons de sang en 2018
La Chine a enregistré 15 millions de dons de sang en 2018