Dernière mise à jour à 15h40 le 06/02
 |
Selon une conférence officielle du 5 février, l'inscription pour des essais cliniques du médicament antiviral Remdesivir a été approuvée, et le premier groupe de patients atteints de pneumonie infectés par le nouveau coronavirus (2019-nCoV) devrait commencer à prendre le médicament dès ce 6 février.
L'approbation a été soutenue conjointement par le ministère des Sciences et Technologies (MOST), la Commission nationale de la santé et l'Administration nationale des produits médicaux.
Le Remdesivir est un médicament développé par Gilead Sciences, une société pharmaceutique américaine, a précisé Cao Bin, chef du programme d'essais cliniques du médicament, lors de la conférence organisée par le MOST à l'hôpital Jinyintan de Wuhan, capitale de la province du Hubei (centre de la Chine) et épicentre de l'épidémie.
Lors d'expériences antérieures sur des cellules et des animaux, le médicament a montré une bonne activité antivirale contre le SRAS et le coronavirus MERS. Ses essais cliniques contre les infections à Ebola ont par ailleurs été menés à l'étranger. Selon M. Cao, il a également montré une assez bonne activité antivirale contre le nCoV 2019 au niveau cellulaire dans des recherches nationales connexes.
Au total, 761 patients ont été inclus dans les essais, qui adopteront une méthode d'étude randomisée, en double aveugle et contrôlée par placebo.
Les essais, menés par l'Hôpital de l'Amitié Chine-Japon et l'Institut de Materia Medica de l'Académie chinoise des sciences médicales (CAMS), seront menés dans plusieurs hôpitaux de Wuhan, dont l'Hôpital Jinyintan.
Des espoirs ont été placés dans ce médicament, mais nous devons attendre les résultats de son efficacité réelle dans les essais cliniques, a de son côté déclaré Wang Chen, vice-président de l'Académie chinoise d'ingénierie et président de la CAMS.
 Hunan : des slacklineurs offrent un spectacle à haute altitude
Hunan : des slacklineurs offrent un spectacle à haute altitude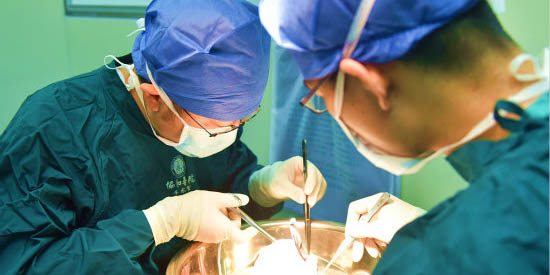 Un hôpital transplante avec succès des reins de bébé à une femme
Un hôpital transplante avec succès des reins de bébé à une femme Deux bronzes de retour en Chine
Deux bronzes de retour en Chine La Chine compte 55 sites au Patrimoine mondial
La Chine compte 55 sites au Patrimoine mondial
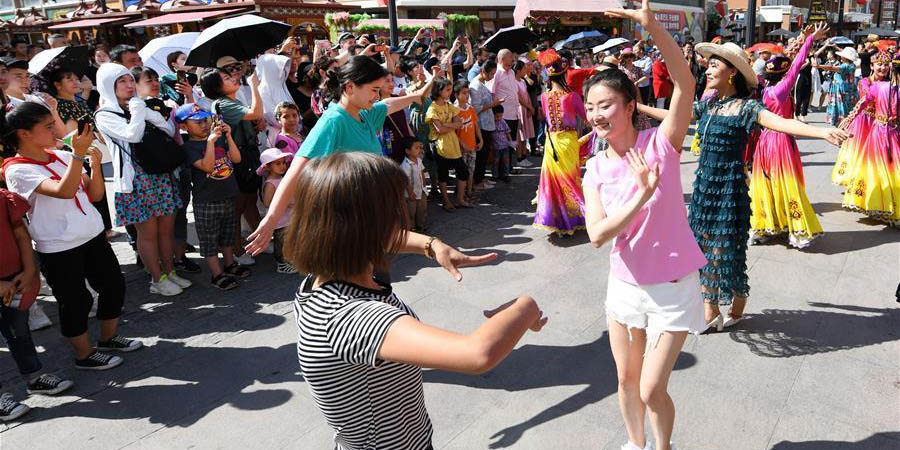 Le grand bazar d'Urumqi entre dans la haute saison touristique
Le grand bazar d'Urumqi entre dans la haute saison touristique Les « animateurs dégustateurs » offrent un festin visuel aux internautes
Les « animateurs dégustateurs » offrent un festin visuel aux internautes Les valeurs culturelles de la Journée internationale des musées dans une perspective mondiale
Les valeurs culturelles de la Journée internationale des musées dans une perspective mondiale Mort à 102 ans de I.M. Pei, l'architecte de la pyramide du Louvre
Mort à 102 ans de I.M. Pei, l'architecte de la pyramide du Louvre Ceux qui veulent nous rejoindre sur la messagerie WeChat, scannez le code QR ci-contre.
Ceux qui veulent nous rejoindre sur la messagerie WeChat, scannez le code QR ci-contre. Lhassa accueille une compétition d'escalade sur le thème « Une Ceinture, une Route »
Lhassa accueille une compétition d'escalade sur le thème « Une Ceinture, une Route » Ouverture à Beijing d'une exposition sur un site chinois du patrimoine mondial
Ouverture à Beijing d'une exposition sur un site chinois du patrimoine mondial Ouverture d'une exposition sur Balzac dans l'est de la Chine
Ouverture d'une exposition sur Balzac dans l'est de la Chine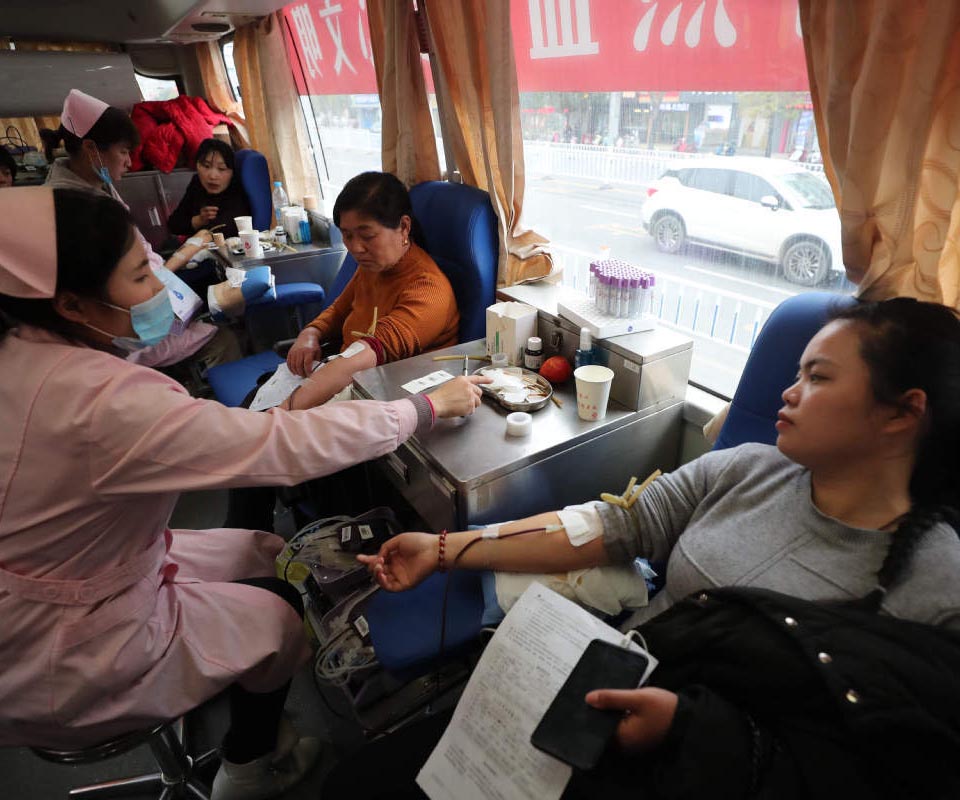 La Chine a enregistré 15 millions de dons de sang en 2018
La Chine a enregistré 15 millions de dons de sang en 2018