Dernière mise à jour à 08h41 le 05/01
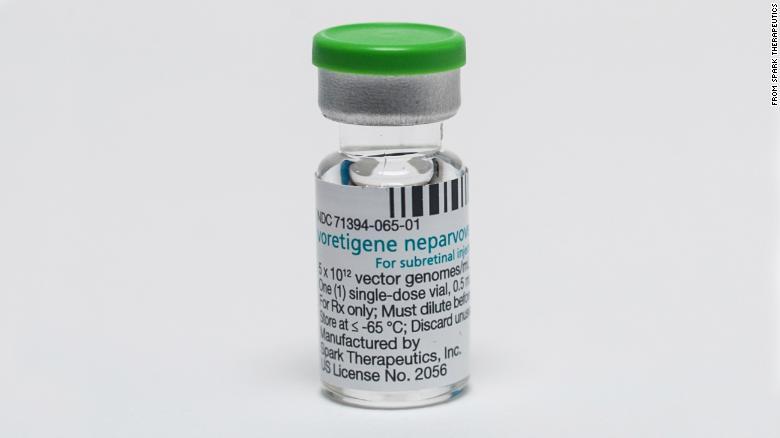 |
C'est un chiffre qui fait tourner la tête : un traitement unique avec le Luxturna, la première thérapie génique approuvée par la Food and Drug Administration américaine pour un trouble héréditaire, coûtera la somme colossale de 425 000 par œil. Spark Therapeutics Inc., le fabricant du voretigene neparvovec, basé à Philadelphie, a annoncé le 3 janvier qu'il avait conclu un accord de principe pour rendre le traitement unique disponible aux patients présentant un défaut génétique rare conduisant souvent à la cécité. Selon un porte-parole de Spark Therapeutics, la mutation affecte les deux yeux et intervient habituellement au même rythme, ce qui fait que la plupart des patients devraient avoir besoin d'un traitement pour les deux yeux.
Dans certains cas, cette thérapie génique sera disponible dans le cadre d'une « entente de remboursement fondée sur les résultats ». La société a également annoncé que sa proposition aux Centers for Medicare et Medicaid Services, le programme gouvernemental américain qui couvre environ 100 millions d'Américains, permettrait des paiements échelonnés pour le médicament. « Pour une thérapie ponctuelle, comme Luxturna, un modèle de paiement et de distribution non traditionnel est nécessaire pour répondre aux besoins de toutes les parties -patients, payeurs et fournisseurs », a déclaré Jennifer Luddy, porte-parole d'Express Scripts.
Le médicament est destiné aux patients atteints de dystrophie rétinienne due à une mutation du gène RPE65. Cette anomalie génétique rare entraîne une déficience visuelle sévère dès l'enfance et peut éventuellement mener à la cécité. La société estime que « la population totale aux États-Unis, en Europe et certains autres marchés dans les Amériques et en Asie/Pacifique est d'environ 6 000 individus » qui sont affectés par la mutation ciblée par le Luxturna, a expliqué Monique da Silva, porte-parole de Spark Therapeutics.
Le Luxturna est un liquide qui est injecté directement dans l'œil avec une aiguille microscopique lors d'une intervention chirurgicale. Le médicament fournit un troisième gène -un gène RPE65 normal- aux cellules de la rétine, une couche de tissu qui tapisse l'arrière de l'œil. Cette troisième version du gène ne supprime pas ou ne remplace pas les deux gènes mutés responsables de la maladie, qui restent à l'intérieur des cellules. Cependant, le gène normal délivré par le traitement est capable de fonctionner dans les cellules rétiniennes et de corriger les problèmes de vision.
 Chine : succès de l'expérimentation du riz de mer
Chine : succès de l'expérimentation du riz de mer Chine : lancement de trois satellites de télédétection
Chine : lancement de trois satellites de télédétection Essai en haute mer du nouveau submersible habité chinois
Essai en haute mer du nouveau submersible habité chinois Trois scientifiques reçoivent le prix Nobel de physique 2017
Trois scientifiques reçoivent le prix Nobel de physique 2017 Chine : lancement d'un vaccin contre le cancer du col de l'utérus
Chine : lancement d'un vaccin contre le cancer du col de l'utérus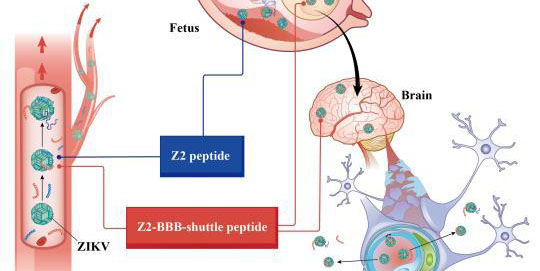 Un traitement contre le virus Zika développé en Chine
Un traitement contre le virus Zika développé en Chine Panda power ! Le nouveau visage de l'énergie solaire en Chine…
Panda power ! Le nouveau visage de l'énergie solaire en Chine… Chine : échantillons collectés par le navire de recherche Kexue
Chine : échantillons collectés par le navire de recherche Kexue Ceux qui veulent nous rejoindre sur la messagerie WeChat, scannez le code QR ci-contre.
Ceux qui veulent nous rejoindre sur la messagerie WeChat, scannez le code QR ci-contre. Shanghai enregistre son jour le plus chaud en 145 ans
Shanghai enregistre son jour le plus chaud en 145 ans Livraison du premier simulateur de vol chinois de haut niveau
Livraison du premier simulateur de vol chinois de haut niveau Le Zoo de Beijing aide ses animaux à faire face à la chaleur estivale
Le Zoo de Beijing aide ses animaux à faire face à la chaleur estivale La canicule se poursuit un peu partout en Chine
La canicule se poursuit un peu partout en Chine Le nombre d'antilopes du Tibet a atteint plus de 200 000 à Changtang
Le nombre d'antilopes du Tibet a atteint plus de 200 000 à Changtang